NOTAS DE QUIMICA GRUPO #3 SEMANA 3
¿QUÉ ES LA ESTEQUIOMETRIA?
La estequiometría es la información de las cantidades de los
reactantes y productos en una reacción química. Esta se basa en que la cantidad
de reactantes es igual a la cantidad de los productos y que los compuestos
tienen una composición fija.
La palabra
"estequiometría" deriva del griego stoicheon (elemento) y metron (medida).
Fue aplicada por Jeremias Benjamin Richter en 1792.
Por ejemplo, en la combustión de metano CH4 en presencia de oxígeno O2 (reactantes) se produce dióxido de carbono CO2 y agua H2O.
¿QUE ES UNA REACCIÓN QUÍMICA?
Las reacciones químicas suceden cuando se rompen o se forman enlaces químicos
entre los átomos. Las sustancias que participan en una reacción química se
conocen como los reactivos, y las sustancias que se producen al final de la reacción se
conocen como los productos.
Por ejemplo, la reacción de descomposición del peróxido de hidrógeno en agua y oxígeno. Las ecuaciones deben estar balanceadas para reflejar la ley de la conservación de la materia, que dice que no se crean ni se destruyen átomos durante el curso de una reacción química normal.
EJEMPLOS DE REACCIONES QUIMICAS:
- Combustión
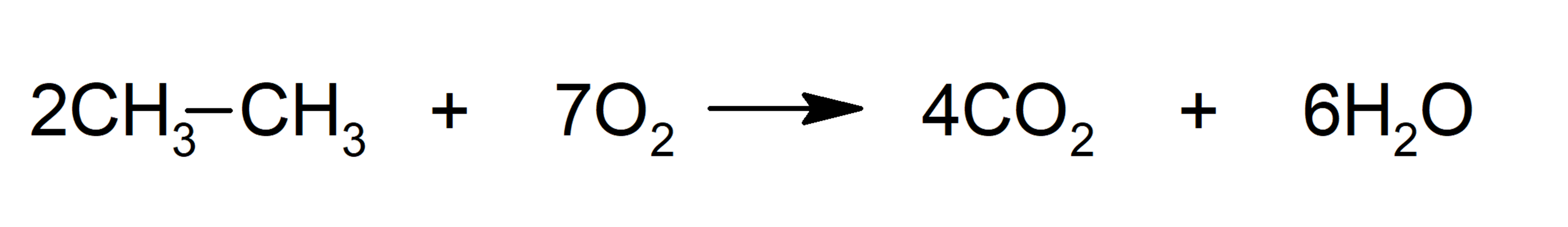
- Sustitución
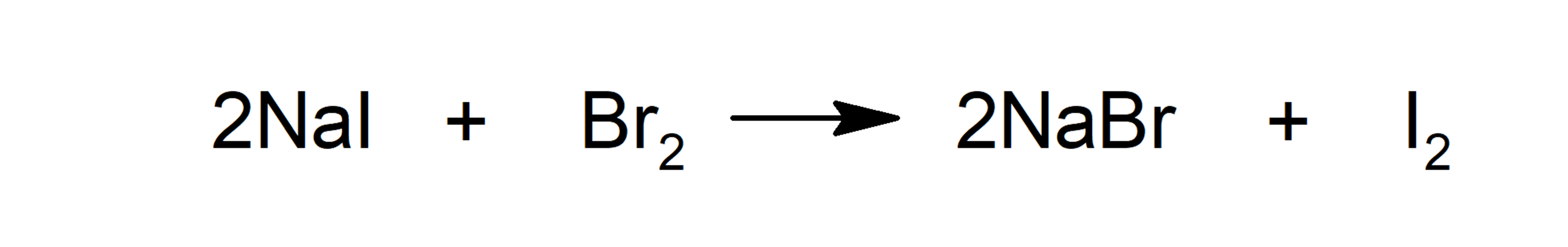
- Adición
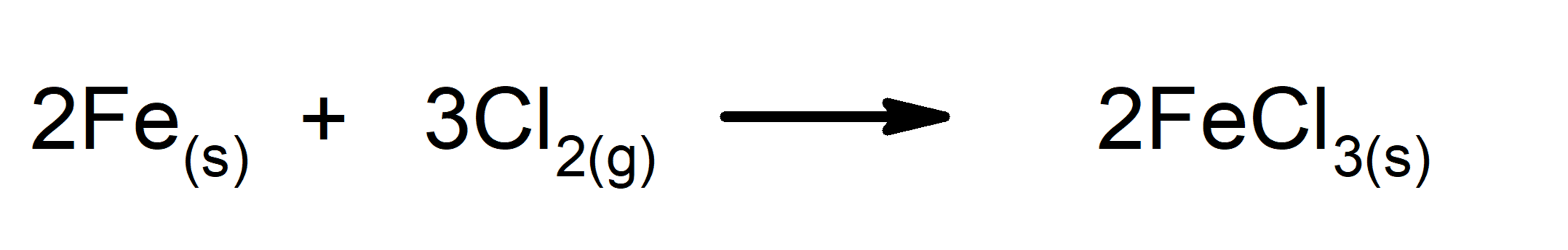
- Eliminación
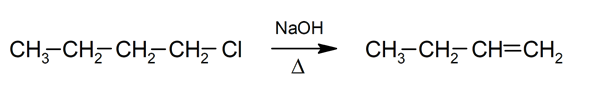
- Oxidación
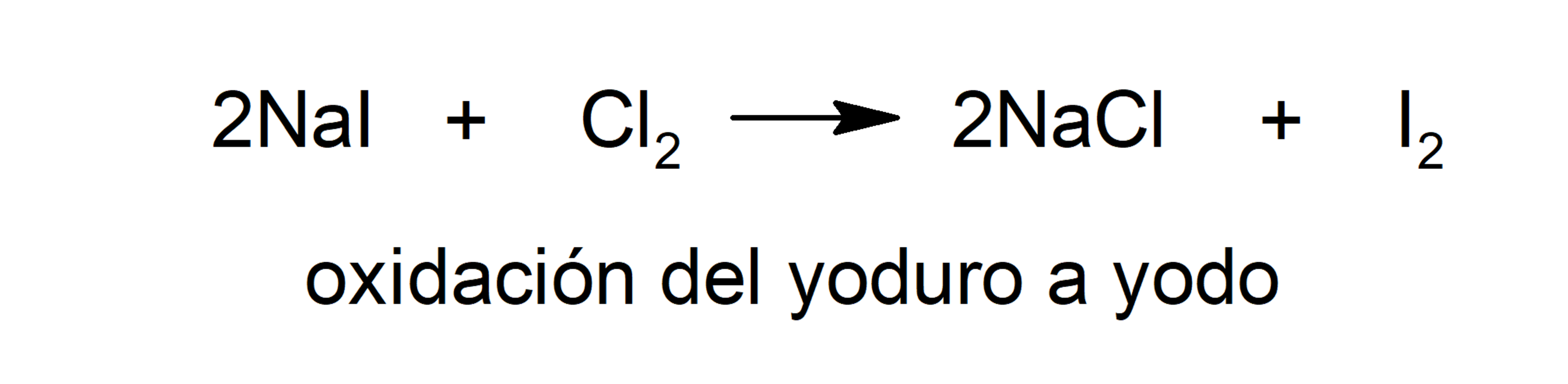
- Reducción

ESTEQUIOMETRIA BALANCEO:


Comentarios
Publicar un comentario