NOTAS DE QUIMICA GRUPO #3 SEMANA 04
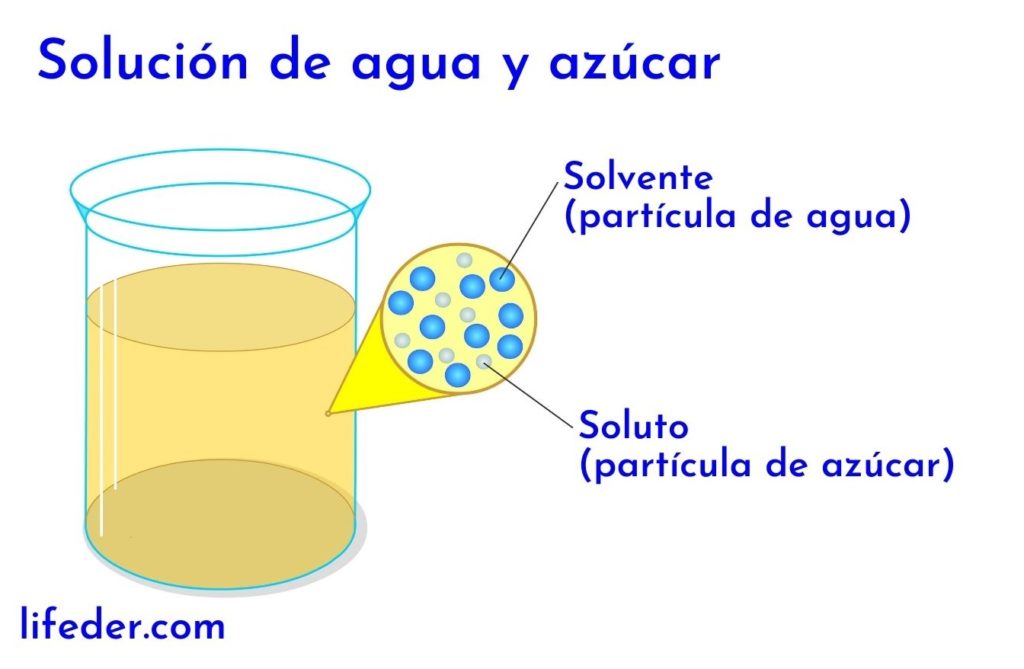
¿QUE ES UNA SOLUCIÓN?
Las soluciones químicas, también llamadas disoluciones, pueden presentar los tres estados de la materia: líquido, sólido y gaseoso. A su vez, sus solutos y solventes también pueden estar en cualquier estado, dando lugar a distintos tipos de soluciones
Concentración de soluciones químicas
La concentración química determinará, en unidades físicas de peso, volumen o partes por millón (ppm), el porcentaje de soluto presente en la solución.
La concentración de soluto en las soluciones se suele expresar en:
- Molaridad: determina la concentración de soluto en moles, dividido en el volumen del solvente. Se suelen utilizar los moles y litros como unidades, es decir, mol (soluto) / l (solvente).
- Molalidad: determina la concentración de soluto en moles, dividido en el peso del solvente. Usualmente, las unidades son moles y kilogramos, es decir, mol (soluto) / kg (solvente).
- Fracción molar: determina la concentración de soluto en moles, dividido en moles de solvente, es decir, mol (soluto) / mol (solvente).
El conocimiento de la concentración en una solución química es importante. Ello determinará la cantidad de soluto y solvente presentes para determinar los factores de cambio y así recrear la solución para su uso o estudio posterior.
Soluciones químicas según el estado de agregación de la materia
A pesar de que las soluciones químicas se suelen encontrar generalmente en estado líquido, también se puede encontrar en estado gaseoso o sólido. Según el estado resultante, las soluciones químicas pueden ser:
- Soluciones sólidas, en el que el estado resultante de la solución química es una mezcla sólida.
- Soluciones líquidas, en el que el estado resultante de la solución química es una mezcla líquida.
- Soluciones gaseosas, en el que el estado resultante de la solución química es una mezcla gaseosa.
En todos los tipos de soluciones químicas, el soluto puede ser de cualquier estado de agregación de la materia. Veamos algunos ejemplos:
- El hidrógeno, en su estado gaseoso, puede disolverse en paladio, en su estado sólido. Esto resulta en una solución química sólida.
- La sal de mesa, en su estado sólido, se disuelve muy bien en agua líquida. El resultado es una solución química líquida.
- El vapor de agua se disuelve en el aire, lo que da lugar a una solución química gaseosa.
- El mercurio, en su estado líquido, se puede mezclar con algunos metales sólidos como la plata, el oro o el estaño. Dependiendo de la proporción de mercurio, la solución química será sólida (mercurio como soluto) o líquida (mercurio como solvente).
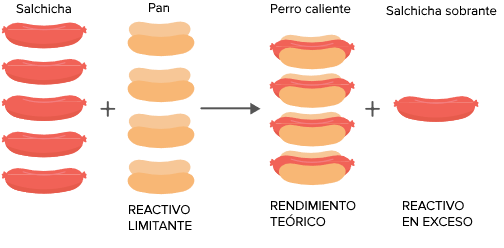
REACTIVO LIMITANTE Y EN EXCESO
RENDIMIENTO DE UNA REACCION ESTEQUIOMETRICA
El rendimiento de una reacción es la cantidad de producto que se puede obtener al llevarse a cabo una reacción completamente. Existen tres tipos de rendimiento:
a) Rendimiento teórico. Es aquel que, por la estequiometría, tendríamos que obtener de acuerdo con la reacción balanceada. Se dice que este rendimiento es lo máximo que podemos obtener.
b) Rendimiento real. Como en muchas de las mediciones o predicción, no siempre sucede lo que “debería”. Este rendimiento es lo que verdaderamente obtenemos en la experimentación. Generalmente es menor al rendimiento teórico.
c) Rendimiento porcentual. Es el rendimiento real entre el rendimiento teórico multiplicado por 100.
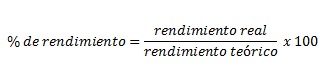
Comentarios
Publicar un comentario